目录
高血壓遺傳概率有多高?父母有高血壓會增加子女患病風險嗎?本文深入探討高血壓的遺傳原因、相關遺傳疾病,以及家族病史的關鍵影響,幫助你了解先天因素與後天預防的關聯,掌握降低遺傳性高血壓風險的方法。
一、高血壓遺傳概率的科學實證
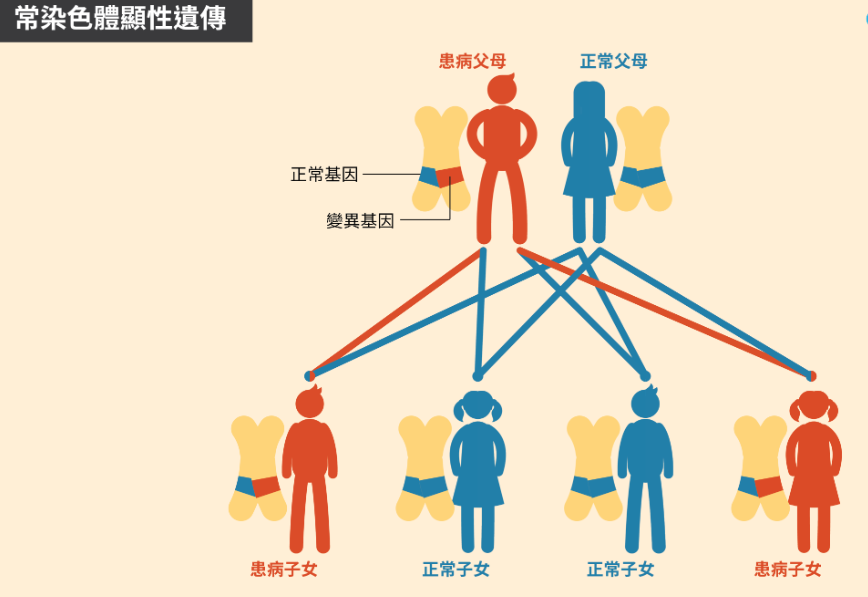
現代醫學研究明確指出,高血壓具有顯著的家族聚集現象。根據台灣國民健康署統計資料,若雙親均有高血壓病史,子女患病機率可達45%-60%;若僅單親患病,遺傳概率約為25%-35%。這遠高於無家族史群體的15%基礎發病率。
更精確的雙胞胎研究顯示,同卵雙胞胎的高血壓共病率高達70%,異卵雙胞胎則降至40%。此差異直接證實遺傳因素的關鍵作用。值得注意的是,遺傳概率會隨年齡增長而顯現,40歲後有家族史者的發病風險曲線明顯陡升。
值得警惕的是,遺傳性高血壓往往呈現「早發型」特徵。臨床觀察發現,有陽性家族史者確診年齡平均比無家族史者提早8-10年,這與多基因累積效應密切相關。
二、高血壓遺傳的分子生物學基礎
目前已知超過150個基因位點與血壓調控相關,主要通過三大路徑產生影響:
1. 腎素-血管收縮素系統基因變異
ACE(血管緊張素轉化酶)基因的I/D多態性會改變酶活性,導致血管過度收縮。AGTR1基因突變則會增強血管對收縮信號的敏感性,這類變異在亞洲人群檢出率特別高。
2. 鈉離子代謝相關基因缺陷
SCNN1B基因編碼的腎小管鈉通道蛋白異常,會引發鈉離子重吸收增加。研究顯示,攜帶此變異者每日鈉滯留量可比常人高出30%,直接導致血容量上升。
3. 內皮功能調節基因異常
eNOS(內皮型一氧化氮合成酶)基因缺陷會減少血管舒張物質生成,這解釋了部分家族性高血壓患者的血管僵硬度異常現象。
值得注意的是,這些基因變異多數屬於「微效基因」,需與環境因素交互作用才會表現。這正是遺傳性高血壓的複雜性所在。
三、遺傳性高血壓的特殊疾病類型
除常見的原發性高血壓外,某些單基因遺傳疾病會直接導致繼發性高血壓:
1. 糖皮質激素可治性醛固酮增多症(GRA)
因CYP11B1/B2基因嵌合突變引起,佔青少年高血壓病例的1%-2%。特徵是早期出現重度高血壓合併低血鉀,需通過基因檢測確診。
2. Liddle氏症候群
上皮鈉通道(ENaC)基因突變所致,表現為頑固性高血壓伴隨代鹼中毒。此類患者對常規降壓藥反應差,需使用阿米洛利等特殊藥物。
3. 多發性內分泌腫瘤2型(MEN2)
RET原癌基因突變引發嗜鉻細胞瘤,造成陣發性嚴重高血壓。此類病例約50%有明確家族史,需進行預防性甲狀腺切除。
這些單基因疾病雖僅佔高血壓患者的5%,但早期基因診斷可實現精準治療,避免器官損害。
四、家族病史的臨床評估要點
完整的遺傳風險評估應包含以下要素: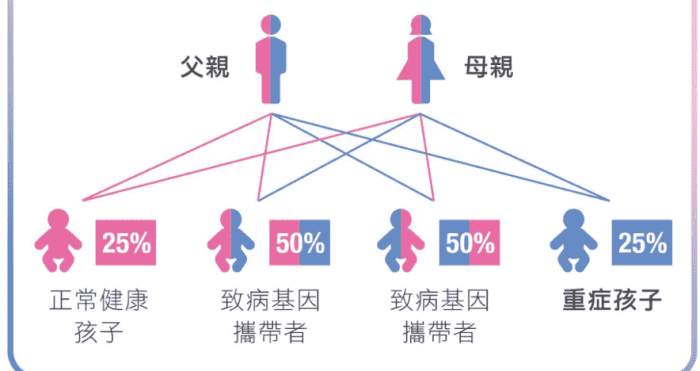
1. 家族譜系繪製
至少追溯三代直系血親,特別記錄:確診年齡(早於55歲具重要意義)、最高收縮壓值、靶器官損害情況(如腦中風、腎衰竭)。橫向親屬(兄弟姐妹)的發病情況尤能反映遺傳負荷。
2. 表型特徵分析
注意特殊表型組合:例如合併低血鉀提示GRA可能,陣發性頭痛出汗需排查嗜鉻細胞瘤。血清醛固酮/腎素比值(ARR)篩查對遺傳性醛固酮增多症有重要價值。
3. 基因檢測適應症
符合以下任一條件建議轉診遺傳諮詢:35歲前發病、多重降壓藥抵抗、合併特徵性代謝異常、一級親屬有青年期心血管事件。全外顯子組測序現已能檢出80%以上的單基因高血壓。
臨床上常見的誤區是過度強調遺傳決定性。實際上,即使高遺傳風險者,透過嚴格的生活方式管理仍可延後發病10-15年。
五、風險管理策略
針對遺傳性高血壓的預防應採分級介入:
1. 初級預防(未發病者)
嚴格執行DASH飲食(每日鈉攝取
2. 次級預防(已確診者)
優先選擇針對性藥物:如ACEi類對RAS基因變異者效果顯著。建議將目標血壓設定較常規標準更低(
3. 家族篩查
確診者的所有一級親屬應從20歲起每年監測動態血壓。對未成年家族成員,建議檢測尿鈉排泄分數(FENa)早期發現鈉代謝異常。
近年興起的多基因風險評分(PRS)技術,已能在症狀出現前10年預測發病可能性,為精準預防提供新工具。
高血壓遺傳具有多層次複雜性,從常見的多基因遺傳到罕見單基因疾病形成連續譜系。理解家族病史不僅有助早期診斷,更能指導個體化治療。值得注意的是,表觀遺傳學研究揭示,即使攜帶風險基因,透過產前營養調控、壓力管理等手段,仍可能改變基因表達模式。這為打破「遺傳宿命論」帶來新希望。
對台灣民眾的具體建議:若家族中有兩位以上早發性高血壓病例,應主動尋求遺傳諮詢;日常實踐低鈉高鉀飲食,並從青壯年期開始規律監測血壓變化。醫療機構則需加強家族史詢問深度,建立高風險家系追蹤系統,才能真正實現遺傳性高血壓的精准防控。